Sensores electroquímicos
Los sensores electroquímicos adecuados para determinar el contenido de oxígeno y los constituyentes nocivos del gas tales como CO, SO2 o NOx, funcionan basándose en el principio de la valoración potenciométrica sensible a los iones.
Los sensores están rellenos con un electrolito acuoso, específico para la tarea, en el que están dispuestos dos o tres electrodos, igualmente combinados específicamente, entre los que hay un campo eléctrico. Los sensores están sellados del exterior mediante membranas permeables al gas.
El diseño específico y el funcionamiento de los sensores difieren según el componente del gas a medir, como se muestra usando dos ejemplos.
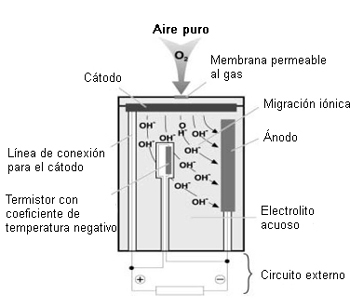
Ejemplo 1: Sensor de oxígeno (sensor de dos electrodos)
Los gases de combustión y las moléculas de oxígeno contenidas en ellos penetran a través de la membrana permeable al gas hasta el cátodo. Debido a su composición material, tiene lugar una reacción química en el cátodo con la formación de iones OH (los iones son partículas cargadas). Estos iones migran al ánodo a través del electrolito, creando un flujo de corriente proporcional a la concentración de O2. La caída de tensión desarrollada en una resistencia situada en el circuito sirve luego como señal de medición que se utiliza para el procesado electrónico posterior.
La resistencia incorporada con coeficiente de temperatura negativo (NTC), se usa para compensar los efectos de la temperatura, garantizando así que el sensor permanezca estable frente a los cambios de temperatura. La duración de un sensor de oxígeno de este tipo es de unos 3 años.
Ecuaciones de reacción del sensor de oxígeno:
En el cátodo: O2 + 2H2O + 4e- ------> 4OH-
En el ánodo: 2Pb + 4OH- ------> 2PbO + 2H2O + 4e-
Balance: 2Pb + O2 ------> 2PbO
Sensor de oxígeno (esquema)
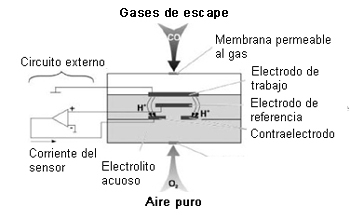
Ejemplo 2: Sensores para CO, SO2 y NOx (sensor de tres electrodos)
Para componentes del gas tales como CO, SO2 o NOx, se usan sensores con tres electrodos.
El funcionamiento se explica basándonos en un sensor de CO; cómo se aplica esto a los otros componentes se puede ver a partir de las ecuaciones de reacción.
Las moléculas de monóxido de carbono (CO) pasan, a través de la membrana permeable al gas, al electrodo de trabajo donde se forman iones H+ como consecuencia de una reacción química. Estos migran en el campo eléctrico al contraelectrodo, donde se genera un flujo de corriente en el circuito externo mediante otra reacción química desencadenada por el oxígeno (O2) del aire puro, también aportado. El tercer electrodo (electrodo de referencia) sirve para estabilizar la señal del sensor. La duración operativa de este tipo de sensor es de unos 2 años.
La duración de este tipo de sensor es alrededor de 2 años.
Ecuaciones de reacción para el CO
Ánodo: CO + H2O --------> CO2 + 2H+ + 2e-
Cátodo: 1/2 O2 + 2H+ + 2e- --------> H2O
Otras ecuaciones de reacción
SO2 + 2H2O ------> H2SO4 + 2H+ + 2e
NO + 2H2O ------> HNO3 + 3H+ + 3e-
NO2 + 2H+ + 2e- ----> NO + H2O
Sensor para CO y otros gases (esquema)